Đề thi giữa kì 1 Hóa 12 có đáp án và kiến thức trọng tâm Hóa lớp 12 sẽ giúp các em học sinh ôn tập bài học từ đầu kì 1 cho đến giữa kì 1; đồng thời làm bài thi, bài kiểm tra được điểm cao. Hãy cùng tham khảo những nội dung Onthidgnl đã tổng hợp sau đây để ôn thi giữa kì 1 môn Hóa 12 thật tốt nhé.

- 1. Ma trận đề thi giữa kì 1 môn Hóa 12
- Kiến thức trọng tâm ôn thi giữa kì 1 môn Hóa 12
- 1 Este
- 2 Lipit
- 3 Glucozo
- 4 Saccarozo, tinh bột và xenlulozo
- 5 Amin
- Dạng bài tập ôn thi giữa kì 1 môn Hóa 12
- 1 Bài tập về este
- 2 Bài tập về lipit
- 3 Bài tập về Glucozo
- 4 Bài tập về Saccarozo, tinh bột và xenlulozo
- 5 Bài tập về Amin
- Đề thi giữa kì 1 Hóa 12 có đáp án tham khảo
- 1. Đề số 1
- 2 Đề thi số 2
- 3.3 Đề thi số 3
1. Ma trận đề thi giữa kì 1 môn Hóa 12
| STT | Nội dung | Đơn vị kiến thức | Mức độ nhận thức | |||
| Nhận biết | Thông hiểu | Vận dụng | Vận dụng cao | |||
| 1 | Este – Lipit | Este | 4 | 2 | 2 | 1 |
| Lipit | 2 | 2 | 1 | |||
| 2 | Cacbohidrat | Glucozơ | 2 | 1 | ||
| Saccarozơ, tinh bột và xenlulozơ | 3 | 1 | ||||
| 3 | Amin, aminoaxit và Protein | Amin | 3 | 2 | ||
| Amino axit | 2 | 2 | ||||
| 4 | Tổng hợp kiến thức | 2 | ||||
| Tổng số câu hỏi | 16 | 12 | 2 | 2 | ||
Cấu trúc đề thi giữa kì 1 môn Hóa 12 bao gồm 32 câu hỏi trong đó 28 câu hỏi trắc nghiệm ở mức độ nhận biết thông hiểu, 4 câu hỏi tự luận ở mức độ vận dụng và vận dụng cao. Số điểm cho mỗi câu hỏi trắc nghiệm là 0,25 điểm/câu, số điểm cho câu hỏi tự luận sẽ được quy định cụ thể trong đề thi.
Kiến thức trọng tâm ôn thi giữa kì 1 môn Hóa 12
1 Este
a. Khái niệm: Este là dẫn xuất của axit cacboxylic được tạo ra bằng cách thay thế nhóm OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm OR’ thì ta được este đơn chức RCOOR’.
Este no đơn chức mạch hở có công thức là CnH2nO2 ( với n 2)
b. Danh pháp: Tên gốc R’ (gốc ankyl) + tên gốc axit RCOO ( đuôi at)
Ví dụ: CH3COO-: Axetat, C6H5COO-: Benzoat, CH2=CHCOO-: Acrylat
c. Tính chất vật lý: Este có nhiệt độ sôi và độ tan trong nước thấp hơn axit và ancol: axit > ancol > este. Mỗi loại este sẽ có mùi đặc trưng khác nhau như mùi chuối chín của isoamyl axetat, mùi dứa của etyl butiat, CH3COOC10H17 tạo nên mùi hoa hồng…
d. Tính chất hóa học
– Este thủy phân trong môi trường axit và tạo ra 2 lớp chất lỏng:
RCOOR’ + H2O RCOOH + R’OH
– Este thủy phân trong môi trường kiềm là phản ứng một chiều ( phản ứng xà phòng hóa)
RCOOR’ + NaOH RCOONa + R’ OH
– Đốt cháy este tạo thành CO2 và H2O. Nếu nH2O = nCO2 => este no đơn chức mạch hở
– Phản ứng tráng bạc ở este:
(HCOO)xR + 2xAgNO3 + 3xNH3 + xH2O → (NH4CO3)xR + 2xAg + 2xNH4NO3
e. Điều chế este:
Axit + Ancol Este + H2O
RCOOH + R’OH RCOOR’ + H2O
2 Lipit
a. Khái niệm: Lipit là những hợp chất hữu cơ có trong tế bào sống. Lipit không hòa tan trong nước nhưng tan nhiều trong dung môi hữu cơ không phân cực.
b. Công thức cấu tạo: Lipit đơn giản cấu tạo gồm gốc axit béo (axit đơn chức có số C chẵn, mạch dài và không phân nhánh) kết hợp với gốc hiđrocacbon của glycerol.
Công thức chung:

Trong đó R1, R2, R3 là các gốc hidrocacbon. Các gốc này có thể giống nhau hoặc khác nhau
c. Tính chất vật lý: Ở nhiệt độ thường, chất béo ở trạng thái lỏng khi trong phân tử có gốc hidrocacbon không no, còn ở trong gốc hidrocacbon no chất béo sẽ ở trạng thái rắn. Chất béo không tan trong nước, nhẹ hơn nước.
d. Tính chất hóa học
– Phản ứng thủy phân trong môi trường axit tạo ra axit béo và glixerol
(CH3[CH2]16COO)C3H5 + 3H2O 3CH3[CH2]16COOH + C3H5(OH)3
– Phản ứng xà phòng hóa tạo thành muối của axit béo và glixerol
(CH3[CH2]16COO)C3H5 + 3NaOH 3CH3[CH2]16COONa + C3H5(OH)3
– Phản ứng cộng hidro của chất béo lỏng thành chất béo rắn
(C17H33COO)3C3H5 (lỏng) + 3 H2 (C17H35COO)3C3H5 (rắn)
3 Glucozo
a. Cấu tạo
– Glucozo có công thức phân tử là C6H12O6
– Glucozo có công thức cấu tạo mạch hở: CH2OH–CHOH–CHOH–CHOH–CHOH–CH=O
Hoặc: CH2OH[CHOH]4CHO
– Glucozo mạch vòng:
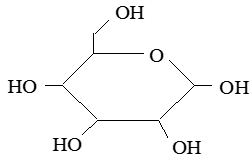
b. Tính chất vật lý: Glucozo là chất kết tinh, không màu, nóng chảy ở 146°C dạng α và 150°C ở dạng β. Glucozo rát dễ tan trong môi trường nước, có vị ngọt và được tìm thấy trong hầu hết các bộ phận của cây như hoa, lá, quả chín… Glucozo có một lượng nhỏ trong máu người, khoảng 0,1%
c. Tính chất hóa học: Glucozo có tính chất của andehit và ancol đa chức
– Tính chất của andehit:
+ Oxi hóa glucozo bằng dung dịch AgNO3 trong NH3 ( Phản ứng nhận biết glucozo bằng phản ứng trang gương)
CH2OH[CHOH]4CHO + 2[Ag(NH3)2]OH CH2OH[CHOH]4COONH4 + 2Ag + 3NH3 + H2O
+ Oxi hóa glucozo bằng Cu(OH)2 trong môi trường kiềm, đun nóng ( nhận biết glucozo)
CH2OH[CHOH]4CHO + 2Cu(OH)2 + NaOH CH2OH[CHOH]4COONa + CU2O + 3H2O
+ Khử glucozo bằng H2
C6H12O6 + H2 C6H14O6
+ Phản ứng lên men: C6H12O6 2C2H5OH + 2CO2
d. Điều chế: Glucozo được điều chế bằng cách thủy phân tinh bột hoặc thủy phân xenlulozo, xúc tác HCl.
e. Ứng dụng: thuốc tăng lực, ruột phích, tráng gương…
4 Saccarozo, tinh bột và xenlulozo
a. Saccarozo (đường kính)
– CTPT: C12H22O11
– Cấu tạo: Trong phân tử saccarozơ có cấu trúc gồm gốc α – glucozơ và gốc β – fructozơ liên kết với nhau thông qua nguyên tử oxi ở giữa C1 của glucozơ đi cùng với C2 của fructozơ (C1 – O – C2). Do nhóm OH – hemiaxetal không còn nên saccarozơ không thể mở vòng để tạo nhóm –CHO. Chính các đặc điểm này cấu thành nên một số tính chất vật lý đặc trưng của saccarozơ.
– Tính chất vật lý: Không màu, dễ tan trong nước, ngọt hơn glucozo, nóng chảy ở 185oC.
– Tính chất hóa học: Saccarozo có tính chất của ancol đa chức và phản ứng thủy phân
+ Phản ứng với Cu(OH)2: 2C12H22O11 + Cu(OH)2 (C12H21O11)2Cu + 2H2O
+ Phản ứng thủy phân: C12H22O11 + H2O C6H12O6 (glu) + C6H12O6 (Fruc)
b. Tinh bột:
– Cấu trúc phân tử: Phân tử tinh bột gồm nhiều mắt xích – glucozo liên kết với nhau và có CTPT là (C6H10O5)n. Các mắt xích
– glucozo liên kết với nhau tạo thành 2 dạng phân nhanh amilozo và không phân nhnah amilopectin.
– Tính chất vật lý: Tinh bột là chất rắn, vô định hình, có màu trắng và không tan trong nước lạnh.
– Tính chất hóa học:
+ Phản ứng thủy phân: (C6H10O5)n + nH2O nC6H12O6 (glu)
+ Phản ứng với iot tạo thành chất màu xanh tím ( phản ứng nhận biết iot hoặc tinh bột)
c. Xenlulozo
– Công thức phân tử: (C6H10O5)n hay [C6H7O2(OH)3]n
– Cấu trúc phân tử: Gồm nhiều gốc β –glucozo liên kết với nhau
– Tính chất vật lý: Là chất rắn dạng sợi, có màu trắng, không tan trong nước và dung môi hữu cơ, tan trong nước Svayde. Xenlulozo là thành phần chính trong bông nõn (98%)
– Tính chất hóa học:
+ Phản ứng thủy phân: (C6H10O5)n + nH2O nC6H12O6 (glu)
+ Phản ứng với axit nitric:
[C6H7O2(OH)3]n + 3nHNO3 (đặc) [C6H7O2(ONO2)3]n + 3nH2O
– Ứng dụng: làm thuốc súng không khói
5 Amin
a. Khái niệm: Amin được tạo ra khi thay thế các nguyên tử hidro (một hoặc nhiều) trong phân tử NH3 bằng một hay nhiều gốc hiđrocacbon.
Ví dụ: CH3CH2CH2NH2 (Propylamin), C6H5NH2 ( Phenylamin), C6H5NHCH3 (Metylphenylamin)
b. Công thức tổng quát:
– Amin đơn chức: CxHyN
– Amin đơn chức no: CnH2n+1NH2 hay CnH2n+3N
– Amin đa chức no: CnH2n+2-z(NH2)z hay CnH2n+2+zNz
c. Đồng phân
– Đồng phân về mạch cacbon
– Đồng phân vị trí nhóm chức
– Đồng phân về bậc của amin
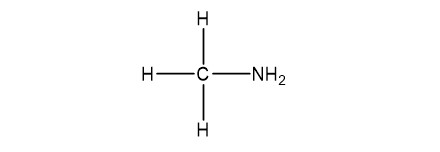
VD: Đồng phân của CH5N
d. Danh pháp
– Tên gốc chức: Sử dụng tên gốc hidrocacbon + amin
– Tên thay thế: Sử dụng tên hidrocacbon + vị trí + amin
e. Tính chất vật lý
– Amin tồn tại ở cả ba thể rắn, lỏng và khí. Amin cấp bậc thấp ở thể khí có mùi khai, dễ tan trong nước và rất độc, cấp bậc cao hơn ở thể lỏng và rắn có vị ngọt và không màu.
– Phân tử khối amin càng tăng thì nhiệt độ sôi tăng dần và độ tan trong nước giảm dần
f. Tính chất hóa học
– Tính base: Amin mạch hở tan nhiều trong nước và làm đổi màu quỳ tím sang xanh hoặc làm hồng phenolphtalein. Anilin và amin thơm khác không làm đổi màu quỳ tím.
– Tác dụng với axit: CH3NH2 + H2SO4 CH3NH3HSO4
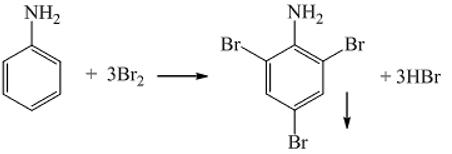
– Phản ứng thế: Anilin cho vào dung dịch nước brom sẽ tạo kết tủa màu trắng.
Dạng bài tập ôn thi giữa kì 1 môn Hóa 12
1 Bài tập về este
a. Các dạng bài về este
– Xác định khối lượng este tham gia phản ứng xà phòng hóa
– Xác định công thức phân tử hoặc công thức cấu tạo của este
– Tính hiệu suất phản ứng este hóa
– Phản ứng đốt cháy este
b. Bài tập luyện tập
Bài 1: Đốt cháy hoàn toàn 4,2g este X thu được 6,16g CO2 và 2,52g H2O. Hãy tìm CTCT của X?
Lời giải: Ta có nH2O = 0,14 mol ; nCO2 = 0,14 mol
nH2O = nCO2 => este X no đơn chức có CTCT: CnH2nO2
=> nCnH2nO2 nCO2
=> n = 2 => C2H4O2 => CTCT của X là HCOOCH3
Bài 2: Một este có CTPT là C4H6O2, khi thủy phân este đó trong môi trường axit ta thu được axetandehit. Hãy tìm CTCT thu gọn của este đó?
Lời giải:
RCOOR’ RCOOH + CH3CHO
=> Este có dạng RCOOCH=CH2 mà có CTPT là C4H6O2 => CH3COOCH=CH2
2 Bài tập về lipit
a. Các dạng bài về lipit
– Xác định khối lượng chất béo tham gia phản ứng xà phòng hóa
– Phản ứng đốt cháy chất béo
– Chất béo không no tác dụng với H2/ Br2
b. Bài tập luyện tập
Bài 1: Để thủy phân chất béo glixerol trisearat cần dung 1,2kg NaOH. Nếu hiệu suất của phản ứng là 80% thì khối lượng glixerol thu được là bao nhiêu?
Lời giải: Ta có phương trình phản ứng:
(C17H35COO)3C3H5 + 3NaOH 3C17H35COONa + C3H5(OH)3 (1)
Ta có nNaOH = 1,2 : 40 = 0,03 mol
Từ (1) => nC3H5(OH)3 = 1/3 nNaOH = 0,01 mol
=> mC3H5(OH)3 = 0,01 x 92 = 0,92 kg
Vì hiệu suất phản ứng là 80% nên khối lượng glixerol thực tế là : 0,92 x 80% = 0,736 kg
Bài 2: Để sản xuất được 1 tấn xà phòng chứa 72% khối lượng natri stearate cần bao nhiêu kg chất béo chứa 89% khối lượng tristeatrin ( 11% tạp chất xơ bị loại bỏ trong quá trình nẫu xà phòng) ?
Lời giải: Ta có phương trình phản ứng:
(C17H35COO)3C3H5 + 3NaOH 3C17H35COONa + C3H5(OH)3
3 Bài tập về Glucozo
a. Các dạng bài về Glucozo
– Xác định khối lượng glucozo tham gia phản ứng
b. Bài tập luyện tập
Bài 1: Hãy tính khối lượng ancol etylic thu được khi lên men 360g glucozo. Biết hiệu suất phản ứng là 100%.
Lời giải: Phương trình phản ứng:
C6H12O6 2C2H5OH + 2CO2
nC2H5OH = 2nC6H12O6 = 2.(360:180) = 4 mol
=> mC2H5OH = 4.46 = 184g
Bài 2: Cho x gam glucozo lên men thành ancok etylic. Khí sinh ra được cho vào nước vôi trong ta thu được 120g kết tủa. Nếu hiệu suất phản ứng là 60% thì giá trị của x là bao nhiêu?
Lời giải:
nCO2 = nCaCO3 = 1,2 mol
=> nglucozo = 0,5.nCO2 = 0,6 mol
=> Khối lượng glucozo thực tế: 0,6.180.60% = 180g
4 Bài tập về Saccarozo, tinh bột và xenlulozo
a. Các dạng bài về Saccarozo, tinh bột và xenlulozo
– Viết phương trình phản ứng về tính chất của Saccarozo, tinh bột và xenlulozo
b. Bài tập luyện tập
Bài 1: Người ta dùng 16,2 tấn xenlulozo sản xuất được 26,73 tấn xenlulozơ trinitrat. Hỏi hiệu suất phản ứng là bao nhiêu?
Lời giải: [C6H7O2(OH)3]n [C6H7O2(ONO2)3]n
162n 297n (tấn)
16,2 26,2.297n:162n = 29,7
%H = 26,73:29,7.100% = 90%
Vậy hiệu suất phản ứng là 90%
Bài 2: Viết phương trình thủy phân xenlulozo, tinh bột, Saccarozo, phương trình đun nóng xenlulozo với hỗn hợp HNO3/ H2SO4
Lời giải:
– Thủy phân xenlulozo: (C6H10O5)n + nH2O nC6H12O6
– Thủy phân tinh bột: (C6H10O5)n + nH2O nC6H12O6
– Thủy phân Saccarozo: C12H22O11 + H2O C6H12O6(glu) + C6H12O6(fruc)
– Đun nóng xenlulozo với hỗn hợp HNO3/ H2SO4:
[C6H7O2(OH)3]n + 3nHNO3 (đặc) [C6H7O2(ONO2)3]n + 3nH2O
5 Bài tập về Amin
a. Các dạng bài về Amin
– Xác định khối lượng amin tham gia phản ứng
– Xác định CTCT của amin
– Phản ứng đốt cháy amin
b. Bài tập luyện tập
Bài 1: Cho 0,1 mol etylamin tác dụng hết với dung dịch HNO2 dư thu được V lít khí N2. Hãy tìm giá trị của V?
Lời giải: C2H5NH2 +HNO2 C2H5OH + H2O
0,1 mol 0,1 mol
=> V = 0,1.22,4 = 2,24 lít
Bài 2: Dùng 21,9g amin đơn chức X phản ứng hoàn toàn với dung dịch FeCl3 (dư) ta thu được 10,7g kết tủa. Tìm số đồng phân bậc 1 của X?
Lời giải: Phương trình phản ứng:
3RNH2 + Fe3+ + H2O 3[RNH3]+ + Fe(OH)3 (1)
Ta có:
Thep phương trình: namin = 3nFe(OH)3 = 3.0,1 = 0,3 mol
=> Khối lượng mol của amoin là 21,9 : 0,3 = 73 g/mol
=> X là C4H9NH2 => Số đồng phân cấu tạo bậc 1 của X là:
CH3-CH2-CH2-NH2
CH3-CH2-CH(NH2)-CH3
CH3-CH(CH3)-CH2-NH2
CH3-C(CH3)NH2-CH3
Đề thi giữa kì 1 Hóa 12 có đáp án tham khảo
1. Đề số 1
a. Đề thi

b. Đáp án
– Phần trắc nghiệm:
| 1. A | 2. D | 3. B | 4. A | 5. B | 6. C | 7. A | 8. B |
| 9. D | 10. C | 11. C | 12. D | 13. A | 14. C | 15. A | 16. C |
| 17. D | 18. D | 19. C | 20. D | 21. D | 22. C | 23. A | 24. C |
– Phần tự luận:
Câu 1:
Ta có ME = 88 => CTPT của E là: C4H8O2
Câu 2:
C6H12O6 2Ag
0,01 0,02 mol
nAg = 0,02 mol
CM = 0,5M
Câu 3:
nNaOH = 0,075 mol
RCOOR’ + NaOH RCOONa + R’OH
Có MRCOONa = 68 => RCOONa là HCOONa.
MRCOOR’ = 88 => HCOO-CH2CH2CH3
Câu 4:
HCOOC2H5 + NaOH HCOONa + C2H5OH
CH3COO-CH=CH2 + NaOH CH3COONa + CH3CHO
(C15H31COO)3C3H5 + 3NaOH 3C15H31COONa + C3H5(OH)3
2 Đề thi số 2
a. Đề thi

b. Đáp án
– Phần trắc nghiệm
| 1. A | 2. B | 3. D | 4. B | 5. B | 6. D | 7. D | 8. C |
| 9. B | 10. B | 11. C | 12. C | 13. A | 14. D | 15. C | 16. A |
| 17. A | 18. C | 19. B | 20. D | 21. A | 22. A | 23. C | 24. D |
– Phần tự luận
Câu 1:
(C6H10O5)n + nH2O nC6H12O6
C6H12O6 2C2H5OH + 2CO2
C2H5OH +O2 CH3COOH + H2O
CH3COOH + CH3OH CH3COOCH3
Câu 2:
C6H12O6 2C2H5OH + 2CO2
CO2 + Ca(OH)2 CaCO3 + H2O
0,05 0,05 (mol)
2CO2 + Ca(OH)2 Ca(HCO3)2
0,2 0,1 (mol)
Ca(HCO3)2 CaCO3 + CO2 + H2O
0,1 0,1 (mol)
=> Số mol CO2 là: 0,2 + 0,55 = 0,75 mol
Số mol C6H12O6 = 1/2 số mol CO2 = 0,75 : 2 = 0,375 mol
Khối lượng glucozo = 0,375.180.100:80 = 84,375 gam
3.3 Đề thi số 3
a. Đề bài


b. Đáp án
| 1. A | 2. D | 3. D | 4. A | 5. B | 6. A | 7. B | 8. A | 9. D | 10. D |
| 11. A | 12. D | 13. C | 14. C | 15. A | 16. A | 17. B | 18. D | 19. A | 20. B |
| 21. A | 22. D | 23. D | 24. D | 25. A | 26. A | 27. B | 28. A | 29. C | 30. A |
Chúc các em ôn tập và thi đạt kết quả cao nhé!
Theo dõi MXH của Onthidgnl để update nhiều tài liệu miễn phí nhé:
FB: https://www.facebook.com/onthidgnlcom

